Jumat, 10 Desember 2021
Apa Itu Larutan ?
Senin, 06 Desember 2021
CONTOH SOAL MATA KULIAH KIMIA DASAR 1 RUMUS MOLEKUL DAN STOIKIOMETRI
CONTOH SOAL MATA KULIAH KIMIA DASAR 1 JURUSAN KIMIA : RUMUS MOLEKUL DAN STOIKIOMETRI
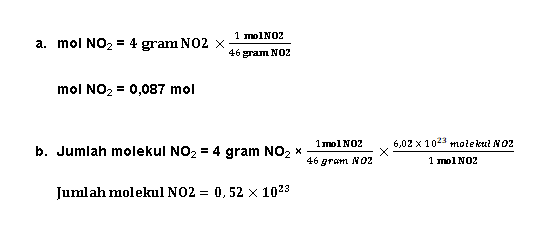
1.
Suatu
sampel H3PO4 komersial 85% massa memiliki berat jenis 1,7
gram/mL. Tentukan berapa molaritas dari asam phosfat tersebut jika diketahui Mr
H3PO4 = 98 gram/mol !
Komponen
utama pencemaran udara kota N2O diketahui mengandung 4 gram NO2.
Jika diketahui Mr NO2 = 46 gram/mol dan bilangan Avogadro = 6,02 x
10^23, maka tentukanlah:
a.
Jumlah
mol NO2 di dalam sampel
b. Jumlah molekul NO2
Jawab
Selasa, 19 Oktober 2021
CONTOH SOAL pH LARUTAN DAN CAMPURAN ASAM BASA DAN PEMBAHASAN
pH LARUTAN DAN CAMPURAN ASAM BASA : CONTOH SOAL DAN PEMBAHASAN
Berapakah pH dari HCl 0,5 M yang diencerkan dari volume 100 mL hingga mencapai volume 1000?
PEMBAHASAN
Diketahui : V1 = 100 ml
V2 = 1000 ml
M1 = 0,5 M
a = 1
Ditanya : pH = ?
Jawab :
M1 × V1 = M 2 × V2
0,5 × 100 = M2 × 1000
50 = M2 × 1000
M2 = 50/1000 = 0,05
[ H+ ] = a × Ma
= 1 × 0,05 = 0,05 = 5×10^-2
pH = - log [ H+ ]
= - log 5 × 10^ -2
= 2 – log 5
Baca Juga : CONTOH SOAL KIMIA DAN PEMBAHASANNYA : MOLARITAS
Hitunglah nilai pH dari larutan H2SO4 0,2 M yang telah diencerkan hingga volume 100 ml dari volume awal 50 ml!
PEMBAHASAN
Diketahui : V1 = 50ml
V2 = 100 ml
M1 = 0,2 M
a = 2
Ditanya : pH = ?
Jawab :
M1 × V1 = M 2 × V2
0,2 M × 50ml = M2 × 100ml
10 = M2 ×100ml
M2 = 10/100 = 0,1
[ H+ ] = a × Ma
= 2 × 0,1
= 0,2
pH = - log [H+]
= - log 2×10 ^-1
= 1 - log 2
Sebanyak 5ml larutan NaOH diencerkan hingga volume 10ml. Berapakah konsentrasi awal dari larutan NaOH tersebut jika setelah diencerkan nilai pH larutan = 12?
PEMBAHASAN
Diketahui : b = 1
V1 = 5ml
V2 = 10ml
pH akhir = 12
Ditanya : M1 = ?
Jawab :
Jika pH = 12, maka :
pOH = 14 – 12
pOH = 2; [OH-] = 10^-2
[ OH- ] = b × Mb
[ OH- ] = b × M2
10^-1 = 1 × M2
M2 = 0,1
M1 × V1 = M 2 × V2
M1 = (M2×V2)/V1
M1 = (0,1×10)/5
M1 = 1/5 = 0,2
Minggu, 17 Oktober 2021
CONTOH PERTANYAAN MENENTUKAN pH ASAM BASSA DAN PEMBAHASAN
CONTOH SOAL DAN PEMBAHASAN : MENENTUKAN pH ASAM BASA
Tentukan nilai pH NaOH jika konsentrasinya 0,1 M !
PEMBAHASAN
Diketahui :
NaOH => basa kuat
b = 1
Mb = 0,1
Ditanya : pH NaOH = ?
Jawab :
[ 〖OH〗^- ] = b × Mb
= 1 × 0,1
= 0,1
=〖10〗^(-1)
pOH = - log〖[ OH^- ]〗
= - log[ 〖10〗^(-1 ) ]=1
pH = 14 – pOH
= 14 – 1=13
Jadi nilai pH dari NaOH yaitu 13
Baca Juga : pH LARUTAN DAN CAMPURAN ASAM BASA : CONTOH SOAL DAN PEMBAHASAN
Hitunglah pH larutan H2SO(4 ) jika diketahiu konsentrasinya 0,04 M !
PEMBAHASAN
Diketahui : H2SO4=>asam kuat
a = 2
Ma = 0,04
Ditanya : pH H2SO4 = ?
Jawab :
〖[ H^+ ]〗=a × Ma
= 2 × 0,04
= 0,08
= 〖8 × 10〗^(-2)
pH = - log [ H^+]
= - log [ 8×〖10〗^(-2)]
= 2 – log 8
Tentukan pH dari asam asetat 0,1 M (diketahui Ka = 〖10〗^(-5)) !
PEMBAHASAN
Diketahui : Ma = 0,1
Ka = 〖10〗^(-5)
Ditanya : pH = ?
Jawab :
[ H^(+ )]= √(Ka ×Ma)
[ H^+] = √(〖10〗^(-5) × 〖10〗^(-1) )
= √(〖10〗^(-6) )
= 〖10〗^(-3)
pH = - log [ H^+ ]
pH = - log [ 〖10〗^(-3)]
pH = 3
Hitunglah nilai pOH dari NH4OH 0,001 M ( diketahui Kb = 10-5) !
PEMBAHASAN
Diketahui : Mb = 0,001
Kb = 10-5
Ditanya : pOH = ?
Jawab :
[ OH- ] = √(Kb ×Mb)
[ OH- ] = √(〖10〗^(-5)×〖10〗^(-3) )
= √(〖10〗^(-8) ) = 10-4
pOH = -log [ OH-]
pOH = - log [10-4]
pOH = 4
NaOH dilarutkan hingga volume 500 Ml. Berapakah pH dari larutan NaOH tersebut jika massa NaOH yang digunakan yaitu sebanyak 8 gram? (Mr NaOH = 40)
PEMBAHASAN
Diketahui : b = 1
V = 500 Ml
massa NaOH = 8 gram
Mr = 40
Ditanya : pH = ?
Jawab :
M=gr/Mr ×1000/(V(mL))=8/40 ×1000/(500 mL)=0,4
[OH-] = b ×Mb
= 1×0,4 = 0,4
pOH = - log [OH-]
= - log 4 ×10-1
= 1 – log 4
pH = 14 – pOH
= 14 – (1-log 4)
= 13 + log 4
Jumat, 15 Oktober 2021
CONTOH SOAL MOLARITAS DAN PEMBAHASANNYA
CONTOH SOAL KIMIA DAN PEMBAHASANNYA : MOLARITAS
Contoh Soal 1
1. Jika sebanyak 80 gram MgCl_2 (Mr=80) dilarutkan ke dalam 100 mL air, berapakah molaritas dari larutan yang dihasilkan?
Pembahasan
Diketahui :
massa MgCl_2 = 80 gram
Mr MgCl_2 = 80
V = 100 Ml
Ditanya : M = ?
Jawab :
M=n/(V(liter))=gr/Mr ×1000/(V(mL))
M = 80gr/80× 1000/100mL = 10 mol/L
Baca Juga : CONTOH PERTANYAAN DAN PEMBAHASAN: MENENTUKAN pH ASAM BASSA
Contoh Soal 2
2. Berapakah massa(dalam gram) NaOH (Mr=40) yang dibutuhkan untuk membuat 1 liter larutan NaOH dengan konsentrasi 0,5 M?
Pembahasan
Diketahui :
M = 0,5 ;
V = 1 Liter = 1000 Ml
Mr NaOH = 40
Ditanya : NaOH =….?gr
Jawab :
M=gr/Mr ×1000/V(mL)
0,5 = gr/40 ×1000/(1000 mL)
gr = 0,5 ×40 ×1=20
Jadi, massa NaOH yang diperlukan yaitu sebanyak 20 gram
Contoh Soal 3
3. Suatu larutan dengan konsentrasi 0,2 M dibuat dengan melarutkan 10 gram zat kedalam 1 liter air. Berapkah massa molekul relatif dari zat tersebut?
Pembahasan
Diketahui :
M = 0,2
massa = 10 gram
V = 1 liter
Ditanya : Mr = ?
Jawab :
M=n/(V(liter))
n = gr/Mr
Mr = gr/n
Mr = 10/0,2=50